La alternativa segura, rápida y eficaz. Ponte implantes cigomáticos en Madrid.
Implantes cigomáticos en Madrid
Las opciones para ser candidato a un implante dental se han multiplicado en los últimos tiempos. Un excelente ejemplo son los implantes cigomáticos.
¿Qué son los implantes cigomáticos?
Los implantes cigomáticos son una innovadora solución odontológica diseñada para restaurar la sonrisa y la funcionalidad en pacientes con reabsorción ósea severa en el hueso alveolar del maxilar superior. A diferencia de los implantes convencionales, los implantes cigomáticos son tornillos de titanio de mayor longitud diseñados específicamente para anclarse en el hueso cigomático o malar.
Dependiendo de la cantidad y calidad del hueso disponible, nuestro equipo altamente especializado puede recomendar diferentes enfoques. Esto podría incluir la colocación de 2 implantes cigomáticos combinados con 2 o 4 implantes convencionales. En casos más desafiantes, nuestra técnica Quad-Zygoma se destaca, implicando la colocación de 4 implantes cigomáticos, es decir, 2 implantes en cada hueso malar.
Los implantes cigomáticos hacen posible la colocación de dientes fijos en 24 horas.

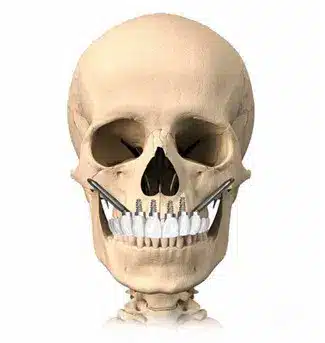
Implantes cigomáticos
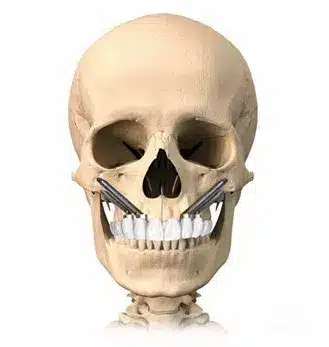
Implantes Quad-zygoma
¿Cómo se colocan?
Los implantes cigomáticos son una alternativa viable para aquellos pacientes con mandíbulas superiores deterioradas que no pueden optar a un implante convencional. Aunque todavía son desconocidos por gran parte de la población, en las clínicas de Salud Dental Blanco en Madrid llevamos años de experiencia y cientos de pacientes tratados con esta tipología. Son una alternativa quirúrgica con niveles de seguridad y éxito altísimos cuando están supervisados y ejecutados por un equipo altamente especializado.
¿Cómo colocamos los implantes cigomáticos? En primer lugar, se coloca una prótesis dental provisional, y después la prótesis definitiva. El implante es insertado en el cigoma o hueso del pómulo. Por lo tanto, no es necesario realizar injertos óseos y facilita la recuperación del paciente tras la implantación. El tiempo de recuperación ronda entre 24 y 48 horas.
Diferencias de los implantes cigomáticos
La diferencia principal entre un implante convencional y uno cigomático es la longitud del mismo y, también, el espacio anatómico donde va ajustado. En concreto, los implantes cigomáticos son una especie de tornillos anclados en la mandíbula superior, cerca del hueso cigoma denso. Aquí radica el éxito de su viabilidad, estos implantes de entre 30 y 52 milimetros llegan hasta el hueso de la mejilla garantizando su resistencia y durabilidad.
Los pacientes no necesitarán de injertos óseos previos haciendo que todo el proceso sea más rápido y efectivo. Una vez realizada la cirugía, el paciente recibe los dientes fijos después de tan solo 3 días. Somos especialistas y pioneros en implantes cigomáticos en Madrid.
Muchas personas preguntan también por la complejidad del procedimiento quirúrgico. Efectivamente el procedimiento es diferente y requiere de un cirujano con gran experiencia. Sin embargo, las molestias para el paciente son muy parecidas a las que tendría con un implante convencional.
¿Cómo saber si es candidato a los implantes cigomáticos?
Para conocer si es candidato a los implantes cigomáticos debe solicitar una consulta personalizada. Es la mejor forma de obtener un diagnóstico certero.
En Salud Dental Blanco nos tomamos muy en serio el proceso previo realizando una evaluación gratuita a cada paciente que incluye también una radiografía 3D sin coste alguno.
Muchas de las opiniones reales que han pasado por nuestras clínicas destacan que la primera visita a Salud Dental Blanco fue reveladora. Se trata de una oportunidad única, sin compromiso alguno, para conocer las modernas instalaciones, la tecnología de vanguardia y, especialmente, la calidad de nuestros odontólogos. Nuestro equipo médico, dirigido por el Dr. Gregorio Comino, tiene la habilidad de explicar todo el proceso de forma directa y clara consiguiendo que el paciente comprenda todo el proceso desde el primer momento. Puede ver los testimonios reales de nuestros pacientes en este enlace.
Beneficios de este tipo de implantes
Los implantes cigomáticos tienen otras alternativas como los implantes corticales o los injertos óseos. Sin embargo, tal y como le explicará nuestro Dr. Gregorio Comino, la tasa de éxito de los cigomáticos es, de forma frecuente, mayor que la regeneración ósea.
Además, se trata de una intervención más rápida y sencilla. El paciente con una pérdida ósea extrema puede recuperar sus dientes y calidad de vida muy rápido.
Las clínicas de Salud Dental Blanco se han convertido en un referente de los implantes cigomáticos en Madrid. Un posicionamiento alcanzado gracias a la inversión constante en calidad e innovación. Calidad en el producto porque todos nuestros implantes son 100% biocompatibles. Calidad en la tecnología disponible en las clínicas. Y calidad en la especialización y atención personal.
¿Aún tiene dudas? Visite nuestro apartado de Opiniones Salud Dental Blanco, seguro que le ayuda a decidirse.
Implantes cigomáticos: La alternativa para la pérdida ósea
Cada día son más los pacientes que acuden a nuestras clínicas porque les habían indicado que no podrían realizarse un implante por falta de hueso.
Los avances de la tecnología, la capacitación de los equipos expertos en implantes dentales y la dilatada experiencia en este campo han evidenciado que recuperar las piezas dentales perdidas es una opción viable para una gran mayoría.
Efectivamente, aquellos pacientes que han estado mucho tiempo sin dientes o con diferentes patologías previas pierden la consistencia de su hueso. Esta atrofia ósea, como denominamos a la falta de hueso bajo la encía, hace que un implante convencional sea inviable o complicado. Sin embargo, las nuevas alternativas, como los implantes cigomáticos, se han convertido en una solución para la recuperación dental en la parte superior. Pide tu cita y estudiaremos tu caso sin ningún compromiso.

¿Quién lleva a cabo la intervención?
La colocación de implantes cigomáticos es realizada por el Dr. Blanco junto con su equipo de cirugía avanzada, formado por:
- Un segundo cirujano Implantólogo.
- Un cirujano maxilofacial.
- Dos instrumentistas.
- Un auxiliar de quirófano.
Este despliegue de un equipo tan cualificado hace posible que cada paso de la intervención se cumpla en los tiempos y con los protocolos establecidos.

¿Cuál es el proceso para su implantación?
- Anestesiología y reanimación: Contamos con un equipo de anestesistas con amplia experiencia profesional. Tras la intervención pasará por la Unidad de Reanimación Post-Anestésica durante aproximadamente 1 hora.
- Aplicación de PRFC (Plasma Rico en Factores de Crecimiento): En el momento de la intervención de implantes cigomáticos, se extrae al paciente una muestra de sangre, que después de 9 minutos de centrifugado extraemos el plasma rico en factores de crecimiento y se aplica en la zona tratada, para conseguir mejores resultados en la regeneración y cicatrización de los tejidos. Esto hace que las molestias postquirúrgicas sean mínimas para el paciente.
- Colocación de prótesis fija de carga inmediata en 24 horas: Tras la intervención, le citaremos en la Clínica para colocarle su prótesis de carga inmediata, con lo que, a partir de ese momento, podrá disfrutar de dientes fijos en menos de 24 horas, tanto en estética como en funcionalidad.
- Colocación de prótesis definitiva de porcelana: Tras el periodo de integración de los implantes cigomáticos, unos 3 meses, tomaremos nuevas medidas para el diseño y fabricación de su prótesis definitiva, cuyo material será determinado por el doctor, según considere la mejor opción. Nuestro técnico especialista en prótesis, considerado uno de los 3 mejores protésicos de Europa, fabricará una prótesis robusta y con alta estética.
- Revisiones necesarias hasta la finalización del tratamiento: Las revisiones derivadas de esta intervención, tales como retirada de sutura, revisiones rutinarias, radiografías de comprobación, etc., están también incluidas en el precio.
- Férula de descarga: Tras la realización de la prótesis definitiva de implantes cigomáticos, confeccionaremos una férula, esto es, una funda fabricada en un material acrílico transparente, que tendrá que utilizar por la noche, con el fin de evitar desgaste o rotura de los dientes por fuerzas involuntarias durante el sueño.
¿Por qué nuestra técnica de implantes cigomáticos es única?
Máxima experiencia en implantes
Para poder abordar este tipo de cirugía, es necesario acceder a la zona destinada al implante con la máxima pericia posible y poder efectuar la separación de los tejidos sin dañar las zonas aledañas.
Exige un amplísimo conocimiento de campo anatómico profundo; de tejidos, nervios y musculatura de esta zona, así como de toda la órbita ocular comprometida. Sin embargo, es necesario contar con el conocimiento y la tecnología necesaria para garantizar el éxito de la intervención.
El Doctor Blanco cuenta con más de 25 años de experiencia de práctica quirúrgica, lo que le convierte en difícilmente igualable en el Sector.
Ser Odontólogo al uso, un gran ponente en conferencias o Universidades, o contar con amplios conocimientos teóricos en implantología, serían inútiles sin la compañía de una práctica diaria en el abordaje de cirugías complejas en Clínica, años de experiencia acompañados de una larga jornada diaria de dedicación a miles de pacientes y gran visión tridimensional con las que cuenta el Doctor Blanco, gracias a su trayectoria profesional y formación en todas y cada una de las especialidades de la Odontología.
Implantes cigomáticos con planificación y férula guiada
El Doctor Blanco realiza una valoración para planificar la colocación de los implantes cigomáticos en tan milimétrico espacio, fabricando una férula guiada que permita facilitar el procedimiento.
A causa de la precisión que requiere esta intervención, es necesario un estudio previo y calcular la densidad ósea, tanto del hueso duro como del esponjoso, mediante un TAC de última generación, con un corte de 0.075 milímetros de precisión inigualable y un campo de visión de 16 centímetros por 17 centímetros, especificaciones mínimamente exigibles y necesarias para la colocación de Implantes corticales e implantes cigomáticos y por supuesto, no disponible ni accesible a cualquier clínica dental al uso.
Se debe planificar digitalmente y ferulizar con guiado digital este espacio para evitar en lo posible los riesgos de una intervención a mano alzada que pudiera derivar en error, aunque lo fuera mínimamente en micras ante un imprevisible fallo humano del cirujano.
Por ello, es aconsejable siempre que la Clínica cuente con esta tecnología de ferulización y previsión digital a pesar de contar con mucha experiencia. El que puedan siempre confeccionar la férula guiada y personalizada del paciente que vehicule la colocación del implante en el espacio exacto y coincidente con la planificación.
Hay otras fórmulas para llevar a cabo este tipo de operaciones, pero solo una férula guiada puede garantizar el 99.8 % de éxito que nos precede y avala nuestros resultados sin igual en el sector.

Implantes cigomáticos + férula guiada
Rellene el formulario y le llamaremos lo antes posible para agendar una cita
LLÁMENOS SI TIENE UNA EMERGENCIA DENTAL
+34 915 09 13 29
Preguntas frecuentes sobre implantes cigomáticos
Vacío
¿Existe posibilidad de complicaciones cuando se realiza un implante cigomático?
Como en cualquier procedimiento quirúrgico, siempre existe la posibilidad de complicaciones. Sin embargo, es importante mencionar que los implantes cigomáticos destacan por contar con una tasa de complicación muy baja.
¿Es dolorosa la recuperación de implantes cigomáticos?
El dolor y la incomodidad después de la cirugía de implantes cigomáticos varían según el umbral del dolor de cada persona, pero en general, se considera normal que haya cierto grado de incomodidad durante los primeros días posteriores al procedimiento. La mayoría de los pacientes encuentran que el dolor es manejable.
¿Cuál es el tiempo de recuperación?
El tiempo de recuperación de la cirugía de implantes cigomáticos suele ser de 2 a 4 días, dependiendo de la complejidad del caso y la capacidad de recuperación de cada paciente.
En general, la recuperación completa puede llevar de 2 a 4 meses. Durante este período, se realizan visitas de seguimiento para asegurar que los implantes están integrándose correctamente en el hueso y que no hay complicaciones.
¿Cuáles son los cuidados que debo tener después de la cirugía?
Es importante seguir todas las instrucciones proporcionadas por el cirujano maxilofacial después de la cirugía. Esto suele incluir una higiene oral meticulosa, evitar alimentos duros o pegajosos, abstenerse de fumar y seguir una dieta específica dependiendo de la fase de cicatrización.
¿Cómo es el procedimiento para colocar implantes cigomáticos?
El procedimiento implica la fijación de los implantes en el hueso cigomático, que es una zona densa y resistente en la región de los pómulos. La cirugía se realiza bajo anestesia local o general, según el caso. Se hace una pequeña incisión en la encía, y luego el implante se coloca y se asegura en el hueso. A continuación, se sutura la incisión y se deja que el implante se integre con el hueso durante el proceso de oseointegración.
¿Hay alimentos que no puedo comer con los implantes?
Durante la fase de cicatrización, es recomendable evitar alimentos duros, pegajosos o muy calientes que puedan ejercer presión sobre los implantes o irritar la zona tratada. Se debe mantener una dieta blanda y evitar morder alimentos con fuerza en la zona de los implantes. Después de la cicatrización, generalmente no hay restricciones alimenticias especiales y se pueden disfrutar de los alimentos con total normalidad.
¿De qué material están hechos los implantes cigomáticos?
Los implantes cigomáticos están hechos de titanio, un material altamente biocompatible que permite la integración con el hueso de manera segura y efectiva.
¿Los implantes cigomáticos se tienen que reemplazar pasado un tiempo?
En condiciones normales, los implantes cigomáticos están diseñados para ser permanentes y no necesitan ser reemplazados, siempre que se mantengan adecuadamente y no haya complicaciones a lo largo del tiempo. Para minimizar la posibilidad de tener que sustituirlo, al igual que cualquier implante dental, es importante tener una buena higiene oral y someterse a revisiones regulares que aseguren su buen estado a lo largo de los años.
¿Cuántas intervenciones son necesarias para la colocación de implantes cigomáticos?
Por lo general, la colocación de implantes cigomáticos se realiza en una sola intervención quirúrgica. Sólo si es necesario realizar procedimientos adicionales o si se combina con otras cirugías maxilofaciales, se podría requerir más de una intervención.oncia.
¿Qué determina el número de implantes?
El número de implantes necesarios puede variar según las necesidades y el diagnóstico de cada paciente. En la mayoría de los casos, se colocan dos implantes en cada lado de la cara para proporcionar una base estable para la rehabilitación protésica. El número exacto de implantes se determinará en función de factores como la calidad ósea, la cantidad de reabsorción ósea y las necesidades específicas del paciente.
Implantes cigomáticos: Opiniones de nuestros pacientes
A continuación puedes ver algunos videos con opiniones de nuestros pacientes sobre implantes cigomáticos. Puedes visitar, también, la página de opiniones sobre Salud Dental Blanco.


Otros tipos de implantes
Los implantes cigomáticos son tornillos largos que se anclan a la parte maxilar. Es una buena solución en caso de falta de hueso en el maxilar superior.
Son implantes largos que se anclan a la zona posterior del maxilar superior, cuando no hay hueso en donde enganchar los implantes convencionales.
Se trata de implantes tradicionales, pero que se colocan de forma inmediata. Sin esperas ni plazos. Lo más cómodo, siempre y cuando tengas hueso en donde ubicarlos.
Una prótesis en donde se enganchan varias piezas dentales. La prótesis es, en este caso, la que se engancha al hueso mediante implantes.
¿Por qué elegir Salud Dental Blanco?
Valoración gratuita y sin compromiso
Uno de nuestros expertos valorará tu caso y te recomendará el mejor tratamiento. Si necesitas implantes, tenemos la última tecnología en implantes corticales e implantes de carga inmediata.
Radiografía 3D gratuita
De forma totalmente GRATUITA, te hacemos una radiografía 3D para enseñarte, de forma precisa, el estado de tu boca. Esta radiografía está valorada en 150 euros… pero no tendrás que pagar absolutamente nada.
Financiación
Para facilitarte más el acceso al tratamiento, Salud Dental Blanco te ofrece una financiación de hasta 60 meses. Para que el dinero no sea un problema si necesitas implantes cigomáticos.

Cirujano. Odontólogo. Especialista en implantes.
Más información sobre nuestro equipo médico.
Solicite más información
Rellene el formulario y le llamaremos lo antes posible para agendar una cita con el Doctor
